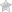Гранулоциты — клетки, в цитоплазме которых обнаруживается зернистость, специфическая для определенного вида клеток. Различают нейтрофильную, эозинофильную и базофильную зернистость.
Нейтрофильная зернистость розовато-фиолетовой окраски, чаще пылевидная, обильная, не всегда равномерно заполняет цитоплазму.
Эозинофильная зернистость однородна по цвету, форме и величине, крупная, занимает всю цитоплазму. В зрелых клетках имеет кирпично-розовый цвет (кетовая икра), в молодых эозинофильных лейкоцитах — коричневый и буро-синий оттенок.
Базофильная зернистость чаще фиолетового, реже черного цвета, неоднородна по величине и форме, обычно необильна, располагается на ядре и в цитоплазме.
Миелобласт
Миелобласт— родоначальная клетка гранулоцитарного ряда. Размер клетки — 10 — 20 мкм. Форма чаще круглая, иногда овальная. Ядро занимает большую часть клетки, круглое или овальное, окрашивается в красно-фиолетовый цвет. Хроматин — мелкосетчатый. Ядерная мембрана очень тонкая. В ядре можно обнаружить от 2 до 7 ядрышек, окрашивающихся в светло-синий, а иногда в красновато-фиолетовый цвет. Цитоплазма базофильная, содержит небольшое количество неспецифических азурофильных гранул.
Микрофотографии миелобластов:
Мнение врача:
Клетки миелоидного ряда играют важную роль в иммунной системе человека. По мнению врачей, эти клетки производят гранулоциты, моноциты и макрофаги, которые являются ключевыми элементами в борьбе организма с инфекциями. Кроме того, клетки миелоидного ряда участвуют в процессе фагоцитоза, поглощая и уничтожая патогенные микроорганизмы. Понимание роли этих клеток помогает в разработке методов лечения различных заболеваний, связанных с нарушением иммунной системы.
Промиелоцит
Промиелоцитобразуется в процесе деления миелобласта, далее из него образуются более зрелые зернистые лейкоциты. Величина клетки колеблется от 12 до 24 мкм. Ядро занимает большую часть клетки, красно-фиолетовое. Форма ядра круглая, овальная или с небольшим вдавлением, располагается чаще эксцентрично. Структура ядра сетчатая, местами более грубая. Ядерная мембрана тонкая. В ядре могут быть видны ядрышки, которые не всегда хорошо выражены. Цитоплазма промиелоцитов чаще имеет значительные размеры, иногда образует небольшой ободок. У более молодых клеток окрашивается в разные оттенки синего цвета, по мере созревания клеток приобретает розовато-голубой цвет. Промиелоцит — первая клетка гранулоцитарного ряда, в которой появляется специфическая зернистость. В зависимости от типа специфической зернистости промиелоцит относят к нейтрофильному, эозинофильному или базофильному ряду. Можно видеть и довольно крупную недифференцированную зернистость (типа азурофильной), окрашивающуюся преимущественно в красно-фиолетовый цвет.
Эозинофильные гранулы на разных этапах развития содержат большое количество кислой базофильной субстанции, воспринимающей щелочные (синие) краски, поэтому большинство гранул окрашивается в грязновато-синий цвет. Такие клетки можно ошибочно принять за базофильные. Во избежание ошибки следует учитывать не только окраску, но и размеры, форму гранул: в клетках эозинофильного ряда они правильной округлой формы и одинакового размера, а в клетках базофильного ряда величина их колеблется от мелких точечных до крупных хлопьевидных образований неправильной формы.
Промиелоциты нередко трудно отдифференцировать от молодых миелоцитов. Основное отличие — расположение зернистости в клетке: у промиелоцита она располагается и в цитоплазме, и на ядре, а у миелоцита — только в цитоплазме.
Микрофотографии промиелоцитов:
Миелоцит
Размер миелоцита— 8 — 18 мкм. В миелоцитах различают две генерации — крупные незрелые материнские миелоциты и меньших размеров зрелые дочерние миелоциты. Дочерние миелоциты образуются из материнских в результате пролиферации и дифференциации. ра миелоцитов сочные , с характерным чередованием более светлых и более темных участков хроматина. Рисунок хроматина в ядре зависит от степени зрелости клеток: более мелкий, сглаженный, рыхлый — у незрелых миелоцитов и более крупный, грубый и густой — у зрелых. Материнскому миелоциту свойственно ядро рыхлой структуры, как бы набухшее, а дочернему — овальное, бобовидное или бухтообразное, глыбчатое. Ядрышки в ядре миелоцита, как правило, отсутствуют.
Цитоплазма нейтрофильного миелоцитаокрашивается в светлый сине- или фиолетово-коричневый тон у материнских форм и розоватый — у дочерних. В центре клетки, вблизи ядра, в области расположения комплекса Гольджи окраска цитоплазмы менее интенсивна. По наличию этого просветления в цитоплазме миелоциты можно легко дифференцировать даже в тех случаях, когда зернистость плохо окрашена или совсем не окрашена (при лейкозах). Зернистость мелкая, такого же типа, как и у зрелых нейтрофильных гранулоцитов, но среди мелких гранул всегда располагаются и более крупные.
Цитоплазма эозинофильного миелоцитаокрашивается в голубой цвет, густо «нафарширована» эозинофильной (ярко-оранжевой) зернистостью, среди которой могут встречаться гранулы синего или фиолетово-красного цвета (более молодая эозинофильная зернистость).
Цитоплазма базофильного миелоцитатакже окрашивается в голубой цвет. Зернистость отличается колебаниями в оттенках окраски отдельных гранул (темно-синяя, синяя, фиолетово-красная), форме и количестве гранул.
В нормальных условиях только дочерние миелоциты через метамиелоцитыпереходят в полиморфные лейкоциты. Материнские миелоциты, не давшие дочерних генераций, могут в дальнейшем развиваться в зрелые полиморфные лейкоциты только в патологических условиях. Такие лейкоциты имеют большую величину и большее количество сегментов в ядре. Кроме этого при патологических процессах, особенно при лейкозах, в миелоцитах отмечается несоответствие в развитии ядра и цитоплазмы, а также зернистости клеток.
Микрофотографии нейтрофильных миелоцитов:
Микрофотографии эозинофильных миелоцитов:
Опыт других людей
Клетки миелоидного ряда – это важная часть иммунной системы, отвечающая за защиту организма от инфекций и болезней. Люди отмечают, что эти клетки играют ключевую роль в поддержании здоровья и борьбе с вирусами. Благодаря своей функциональности, клетки миелоидного ряда помогают организму эффективно справляться с различными вызовами внешней среды.
Метамиелоцит (юный)
Размер метамиелоцита от 10 до 16 мкм. Ядро занимает около половины клетки и имеет подковообразную, почкообразную или колбасообразную форму. Ядро более компактное по сравнению с миелоцитами.
Цитоплазма нейтрофильного метамиелоцитабледно-розового цвета, но иногда бывает сероватой или светло-синей. В цитоплазме содержится нейтрофильная зернистость (фиолетового цвета), разная по величине и расположенная по всей цитоплазме. Эозинофильный метамиелоцитимеет бледно-голубую цитоплазму, эозинофильную зернистость, расположенную по всей цитоплазме. Базофильные метамиелоцитыне всегда можно точно распознать из-за того, что за крупной темной зернистостью не удается разглядеть форму, величину и структуру ядра. В таком случае клетку рекомендуется относить к зрелым базофилам.
Микрофотографии нейтрофильных метамиелоцитов:
Микрофотографии эозинофильных метамиелоцитов:
Eosinophilic myelocyte, eosinophilic metamyelocyte, mitosis
Палочкоядерные гранулоциты
Размер палочкоядерных гранулоцитов — 9 — 12 мкм. Ядерно-цитоплазматическое отношение сдвинуто в пользу цитоплазмы. Ядро имеет вид палочки (часто изогнутой), иногда с сужениями, сохраняющими двухконтурность. Хроматин грубой структуры.
У нейтрофильного палочкоядерного гранулоцитацвет цитоплазмы розоватый с фиолетовым оттенком; зернистость большей частью обильная, но не всегда равномерно заполняет цитоплазму.
У эозинофильного палочкоядерного гранулоцитацитоплазма неясного голубого цвета, мало заметного из-за обильной эозинофильной зернистости. Базофильные палочкоядерные гранулоцитыпрактически не встречаются.
Микрофотографии палочкоядерных нейтрофилов:
Микрофотографии палочкоядерных эозинофилов:
Band eosinophil, mature neutrophil, Normal blood
Сегментоядерные гранулоциты
По размеру и ядерно-цитоплазматическому соотношению cегментоядерные гранулоциты аналогичны палочкоядерным гранулоцитам. Ядро полиморфное, разделено на сегменты, соединенные тонкими одноконтурными перемычками, окрашивается в темно-фиолетовый цвет.
Ядра нейтрофильных сегментоядерных гранулоцитовимеют в норме 2 — 5 сегментов, цитоплазма розовая или розово-фиолетовая, содержит нейтрофильную зернистость.
Ядра эозинофильных сегментоядерных гранулоцитовимеют обычно 2 сегмента, реже 3 или 4. Цитоплазма заполнена эозинофильной зернистостью. Базофильный сегментоядерный гранулоцитимеет трехсегментированное или лопастное ядро. Цитоплазма бледно-розового или фиолетового цвета. Крупная темно-фиолетовая зернистость располагается и на ядре, и в цитоплазме.
Микрофотографии зрелых базофилов:
Все вышеописаные клетки в соответствующих количествах встречаются в нормальном костном мозге, в периферической крови взрослого человека в норме встречаются только зрелые клетки — палочкоядерные и сегментоядерные гранулоциты.
В ряде случаев, при наследственных или приобретенных патологических состояниях, в гранулоцитах наблюдаются определенные морфологические нарушения (изменения), которые можно разделить на две группы: дегенеративные изменения и конституциональные аномалии.
Симптомы и лечение острого лейкоза
Острый лейкоз – тяжелое и опасное заболевание системы крови, трудно поддающееся лечению и нередко приводящее к летальному исходу. Это одна из пока нерешенных проблем современной медицины.
Что такое лейкоз?
Лейкемия – это собирательное понятие, которым обозначают обширную группу заболеваний. В народе данная патология также называется белокровием.
Под влиянием провоцирующих факторов среди незрелых гемопоэтических клеток, созревающих или зрелых кровяных клеток появляется злокачественный клон, который, делясь, дает в дальнейшем начало прогрессивно растущему поколению недоброкачественных клеток.
Появление таких двойников происходит в результате мутации. Мутировавшие клетки не только приобретают новые свойства, но и передают их следующим поколениям.
Что такое острый лейкоз, становится очевидно, если сравнить скорость распространения патологических клеток при острой и хронической формах. В первом случае темпы прогрессирования патологии значительно выше. Хронический лейкоз протекает более длительно.
Провоцирующие факторы
Однозначного решения по вопросу, что считать непосредственной причиной развития белокровия, на сегодняшний день не принято. Хотя причины острого лейкоза устанавливаются по сей день, но на основании клинического опыта уже очерчен круг патогенных факторов, провоцирующих начало болезни:
- Влияние агрессивных химических соединений. Среди токсических воздействий следует отметить и табакокурение, способное спровоцировать начало лейкемии (в данном случае миелоидного типа). Миелоидный лейкоз также может быть спровоцирован длительным контактом с бензином.
- Воздействие на организм радиоактивного излучения. Например, такое происходит по производственной необходимости или в случае лечения другого онкологического заболевания с применением лучевой терапии.
- Наличие в анамнезе упоминаний о применении препаратов цитостатического действия, а также об эпизодах химиотерапии для лечения онкологических заболеваний (цитостатики и химиотерапия могут явиться пусковым механизмом для начала развития миелолейкоза).
- Отягощенная наследственность.
- Заболевания вирусной этиологии также могут провоцировать развитие острого лейкоза.
- Причины заболевания могут заключаться и в генетической патологии (например, синдром Дауна).
Классификация лейкозов
В зависимости от темпов распространения атипичных злокачественных клеток принято различать острые и хронические лейкозы. От формы зависит и степень поражения опухолевыми клетками различных органов и тканей. Эти факторы влияют на течение лейкоза. Классификация помогает систематизировать различные формы патологии.
Виды острого лейкоза
Что такое острый лимфобластный лейкоз
Острый лимфобластный лейкоз что это такое? Лимфобластный лейкоз в острой форме (ОЛЛ) поражает, прежде всего, костный мозг, позже – вилочковую железу, селезенку и лимфатические узлы.
Острый лимфолейкоз у детей примечателен тем, что атипичные, злокачественные клетки обнаруживаются не только в веществе костного мозга, но и в периферической крови и даже в тканях некоторых органов. Дифференцировка злокачественных клеток останавливается на уровне лимфобластов. Эта особенность и обуславливает название данной формы заболевания.
Такая разновидность лейкоза B-типа дает показатель выживаемости в детских возрастных группах около 60 %; а острый лимфобластный лейкоз у взрослых – 30 %.
При Т-типе лимфобластного лейкоза течение более тяжелое, а прогнозы – более мрачные.
Наиболее частым злокачественным заболеванием для детского возраста является острый лимфобластный лейкоз. Причины его однозначно не установлены, а провоцирующие факторы – это в основном токсические воздействия и ионизирующая радиация.
Лечение хронического лимфолейкоза, как правило, заключается в химиотерапии в сочетании с пересадкой костного мозга.
Острый миелобластный лейкоз
Миелоидный лейкоз – хронический (ХМЛ) и острый (ОМЛ) — диагностируется у пациентов различных возрастов. Однако наиболее типично развитие острого миелоидного лейкоза у взрослых в возрасте более 40 лет. Симптомы у взрослых и детей обычно схожи.
Прогноз при этой форме заболевания более благоприятный, чем при лимфобластной лейкемии. Добиться частичной ремиссии удается у 80 % заболевших, а полной — у 25 %.
Злокачественные клетки локализуются, в основном в костном мозге. Печень, селезенку и лимфоузлы атипичные клетки поражают на поздних стадиях. Нередко страдают также слизистые оболочки желудочно-кишечного тракта, что приводит к довольно серьезным осложнениям вплоть до язвенных поражений.
Возможны также поражения легочной ткани, а существенно реже – мозговых оболочек.
Хронический миелобластный лейкоз (ХМЛ), в отличие от острой формы, протекает менее стремительно. Однако и при хроническом миелоидном лейкозе ситуация требует скорейшего подбора корректного лечения. При хроническом миелолейкозе симптомы на начальных стадиях могут и вовсе отсутствовать, поэтому диагностика основывается только на лабораторных данных.
Клиническая картина острого лейкоза
Несмотря на то, что для постановки точного диагноза требуется целый ряд диагностических мероприятий и лабораторных тестов, различные виды лейкозов имеют тем не менее и схожие симптомы.
При наличии хотя бы одного, а тем более нескольких симптомов, следует обратиться к врачу для обследования и исключения диагноза лейкоз.
Острая форма развивается стремительно, поэтому времени терять нельзя. Прогноз для жизни больного во многом зависит от своевременности обращения за помощью.
При хроническом лейкозе симптомы, как правило, выражены меньше. Лейкемия хроническая, в отличие от острой, может заявить о себе уже на поздних стадиях.
Общая симптоматика
В этом разделе объединены симптомы острого лейкоза, вызванные ухудшением общего состояния организма. На первичный прием в поликлинике пациент может попасть именно с этими общими симптомами.
При отсутствии специфической симптоматики развитие заболевания можно заподозрить по следующим признакам:
- Существенное снижение веса и объемов тела без видимых причин (диет, изменений в рационе, препаратов для снижения веса).
- Прогрессирующее ухудшение самочувствия, проявляющееся все более выраженной усталостью, утомляемостью.
- На начальных стадиях заболевания вероятно появление внезапных приступов слабости, сонливости, необоснованной усталости.
- Ощущение дискомфорта, тяжести в животе, особенно выраженной в области левого подреберья. Причем появление данных симптомов никак не связано с характером, калорийностью или количеством пищи.
- Необычно частая заболеваемость инфекционными заболеваниями (в том числе ОРЗ, ОРВИ).
- Гипергидроз. Одним из характерных признаков лейкоза на ранней стадии является появление выраженной потливости тела.
- Резкое снижение аппетита вплоть до его исчезновения – еще один признак, по которому можно заподозрить острую форму лейкемии.
- Признаки лейкемии у женщин могут дополняться увеличением времени и интенсивности менструального кровотечения. Лейкоз у женщин протекает на фоне почти постоянного снижения числа эритроцитов.
Неспецифические симптомы
Развившийся острый лейкоз крови приводит к падению количества эритроцитов в общем кровотоке (вследствие замещения здоровых клеток костного мозга злокачественными). Постепенно снижается и число лейкоцитов и тромбоцитов. Это приводит к развитию неспецифических симптомов лейкемии. При хроническом лимфолейкозе симптомы, в отличие от острой формы, выражены менее резко.
Под влиянием прогрессирующего снижения количества эритроцитов появляются признаки, указывающие на развитие анемии: бледность кожных покровов, прогрессирующая усталость, появление одышки при выраженной анемии даже в покое.
- В связи с падением содержания тромбоцитов в крови пациент отмечает появление кровоподтеков. Появляются кровоточивость десен, носовые кровотечения (в частности хронический лимфолейкоз проявляет себя кровотечениями на протяжении длительного времени).
- При поражении, помимо костного мозга и тканей других органов, развиваются расстройства функций пораженных органов, в том числе головные боли, слабость, судорожный синдром, зрительные патологии, двигательные нарушения, в том числе, нарушение походки.
- Болевой синдром. Боли ноющего характера со стороны костей, суставов, затронутых патологическим процессом.
- Увеличение размеров лимфоузлов, селезенки, печени.
- Острый миелолейкоз может проявляться поражением десен в виде набухания и болезненности. Возможно и появление сыпи на деснах.
- Острый лимфоидный лейкоз поражает тимус (вилочковую железу), что приводит к увеличению ее размеров, вследствие чего появляются затруднения при дыхании, одышка.
- Отеки рук и лица считаются наиболее опасными признаками, которыми проявляется острая лейкемия. Эти симптомы свидетельствуют о нарушении кровоснабжения, в том числе и головного мозга.
Лабораторные данные
Острый миелоидный лейкоз характеризуется резким увеличением количества в крови лейкоцитов на начальных стадиях. Показателем особенно тяжелого течения миелоидного лейкоза можно считать резкое увеличение числа базофилов.
Диагностика
- Осмотр пациента.
- Подсчет содержания форменных элементов в анализе крови.
- Установление локализации поражения. С этой целью производится исследование костного мозга. Диагноз острый или хронический лимфоцитарный лейкоз без пункции костного мозга невозможен.
- При распространении патологического процесса на лимфатические узлы производится их биопсия.
- Цитогенетический анализ злокачественных клеток с целью выяснить их подробные характеристики.
- Определение уровня иммуноглобулинов в крови. Это исследование помогает определить риск заболеваемости инфекционными заболеваниями для данного пациента. Этот параметр также влияет на прогноз заболевания.
- Для выявления очагов поражения в органах и тканях проводится компьютерная или магнитно-резонансная томография (например, в случае поражения центральной нервной системы при остром лимфобластном лейкозе одних симптомов недостаточно, нужна визуализация).
Подходы к лечению
Единого подхода к проблеме, как лечить лейкоз, на сегодняшний день нет. Лечение острого лейкоза осуществляется при помощи нескольких методик, выбор которых зависит от возраста пациента, содержания лейкоцитов в анализе крови, динамики симптомов этого заболевания на фоне химиотерапии, сопутствующей патологии.
На ранних стадиях благотворное влияние оказывает общеукрепляющая терапия.
Питание при лейкозе крови обязательно должно быть сбалансированным. Диета при лейкозе должна содержать необходимое количество витаминов и микроэлементов.
Химиотерапия
Данная методика подразумевает уничтожение злокачественных клеток посредством воздействия на них специально предназначенными для этого препаратами. Химиотерапия считается наиболее действенным методом борьбы с атипичными клетками при остром лейкозе и применяется в качестве основного метода. Однако, не смотря на очевидную эффективность химиотерапии, ее применение может дать довольно серьезные последствия для пациента, поскольку имеет немало нежелательных побочных эффектов.
Негативные влияния химиотерапевтических препаратов связано с тем, что наряду с опухолевыми клетками, погибает и значительное количество здоровых, в том числе клеток костного мозга, слизистых оболочек желудочно-кишечного тракта, волосяных фолликулов. Соответственно, побочные эффекты от химиотерапии связаны с многочисленными нарушениями со стороны пищеварительной системы, облысением, дистрофией кожи.
Для профилактики развития в ослабленном химиотерапией организме перед началом курса пациенту предписывается терапия антибиотиками широкого спектра действия.
При хроническом лимфолейкозе лечение, как правило, довольно длительное, но есть возможность достичь устойчивого эффекта.
Трансплантационный метод: пересадка стволовых клеток
Трансплантация стволовых клеток призвана возместить недостаток стволовых клеток при остром лейкозе. Лечение при помощи трансплантации применяется, как правило, совместно с химиотерапевтическим методом.
Пересаженные в костный мозг пациента стволовые клетки способствуют развитию поколений здоровых клеток, производящих форменные элементы крови.
Чаще всего для пересадки стволовые клетки берутся у здорового донора, а в организм больного их можно ввести в виде внутривенного переливания крови.
При успешно проведенной операции польза лечебного метода очевидна, однако необходимо учитывать многочисленные противопоказания и побочные эффекты.
Используется и переливание крови или форменных элементов.
При хроническом миелолейкозе лечение при помощи трансплантации костного мозга может привести к практически полному выздоровлению.
Лучевая терапия
Данный лечебный метод используется существенно реже. Например, при остром лимфобластном лейкозе или хроническом лимфолейкозе (ХЛЛ) лечение таким способом призвано остановить рост злокачественных клеток.
Хирургическое лечение
Применяется в крайних случаях и заключается в удалении селезенки. Хронический миелолейкоз при таком лечении отступает. Эффективность методики существенно возрастает в сочетании с химиотерапией.
Народные средства
Лечение лейкоза народными средствами упоминается в некоторых источниках, однако вряд ли подобным образом можно вылечить острый лейкоз. Симптомы в некоторых случаях могут на некоторое время регрессировать, но на патогенез острых и хронических лейкозов лечение народными средствами повлиять не в силах.
Для лечения и профилактики повышенного АД изобретено множество препаратов и методик. Одной из новинок стал аппарат Самоздрав от давления. Тренажер дыхания помогает оздоровить весь организм за счет нормализации уровня углекислого газа (СО2) в крови, избавиться от таких недугов, как гипертония, сахарный диабет, расстройства ЖКТ, запор и многое другое. Производитель обещает, что использование аппарата Самоздрав поможет избавиться от целого ряда сложных патологий, не используя дорогостоящие лекарственные препараты и сложные медицинские процедуры.
Что такое аппарат Самоздрав?
Тренажер дыхания, состоящий из двух пластиковых камер и трубки, предназначенной для вдыхания и выпускания воздуха. Полезное действие аппарата происходит за счет выдыхаемого из легких воздуха. В камерах тренажера воздух смешивается и дополнительно насыщается углекислым газом, выходящим при выдохе. Регулярные тренировки на протяжении 30 минут ежедневно помогают восстановить, нарушенный уровень СО2 в крови пациента. Аппарат относится к домашней медтехнике и не используется в официальных медицинских учреждениях. Аналогичным Самоздраву называют тренажер Фролова, однако устройство его более модернизировано.
Принципы лечебной терапии тренажера
Нормальный уровень углекислого газа в артериальной крови человека составляет 6%.
Приспособление помогает восстановить уровень углекислого газа.
Он выделяется в кровь после использования клетками кислорода и выводится при выдохе. Однако СО2 выполняет важную роль, предотвращая спазмы микрососудов, подающих кровь к клеткам органов организма. Возраст, стрессы, патологии, вредные привычки ведут к понижению уровня углекислого газа, вызывая спазмы артериол. Нарушается кровоснабжение органов, наступает кислородное голодание, поднимается давление и усиливается сердцебиение. Недостаток кислорода провоцирует дисфункцию большинства органов и систем организма. Опираясь на такую последовательность, производитель обещает покупателям, что тренажер Самоздрав, за счет нормализации уровня углекислоты в крови, нормализует роботу сердечно-сосудистой системы, восстановит нарушенные функции желудка, почек, печени, органов дыхания и головного мозга.
Мнения квалифицированных медиков не совпадают с оптимистическими прогнозами разработчиков методики тренировочного дыхания. Аргументами опровержения становится тот факт, что повышение наполнения углекислым газом белка, который отвечает за перенос газов в клетки, приводит к снижению процента кислорода, из которого также состоит белок. Риск кислородного голодания органов, заставляет задуматься о чудодейственности инновационной разработки.
Показания и противопоказания к использованию
Использовать терапевтическое влияние дыхательного тренажера рекомендуют для лечения ряда заболеваний:
- нарушения в работе ЖКТ;
- патологии сердца и сосудов;
- заболевания опорного аппарата;
- повышенное давление;
- недостаточность кровоснабжения головного мозга;
- бронхиальная астма;
- холецистит;
- гастрит;
- диабет второго типа;
- запоры.
Дыхательный тренажер нельзя использовать после приступа.
Нормализация дыхательного режима является полезной для нормального функционирования клеток организма в целом. Восстановление естественных сил, используемых организмом для поддержания высокого уровня иммунитета и компенсации возрастных изменений в организме. Противопоказаниями к использованию аппарата для нормализации дыхания являются воспалительные заболевания легких, острые формы гипертонического криза, острые вирусные заболевания. Медики добавляют в список риска предрасположенность к инсультам и хроническую кислородную недостаточность.
Многие из болезней, указанные в списке показаний, развиваются по ряду причин, не связанных с нарушением уровня углекислого газа в крови. Поэтому и лечить такие патологии дыхательным тренажером будет не совсем правильно.
Курс лечение с помощью тренажера для давления Самоздрав
Собрав по схеме тренажер, нужно занять удобную позицию и дышать в нормальном режиме. Вдох и выдох только через рот, нос при этом закрывается ватными тампонами, рукой или специальной прищепкой. Во время терапии не должно появляться чувство тяжести дыхания. Если дыхательный ритм сбивается, появляется отдышка или дискомфорт, необходимо прервать тренировку и постепенно продлевать время занятий, по несколько минут в день. После первой полноценной процедуры можно начинать лечение. Этапы тренировочной терапии описаны в таблице.
| Длительность лечения в месяцах | Метка на стакане | Использование жидкости | Объем используемой стеклянной банки | |
| Этап 1 | 1—1,5 | 1 | Не использовать | Не использовать |
| Этап 2 | 1—1,5 | 1 | 0,65 л | |
| Этап 3 | 1—3 | 1 | 1 л | |
| Этап 4 | 1—3 | 1 | 1,5 л | |
| Этап 5 | 1—3 | 1 | 3 ст. л. теплой кипяченой воды | 2 л |
| 0,5 | 2 | |||
| 0,5 | 3 | |||
| 0,5 | 4 |
Что нужно знать?
Прежде чем использовать аппарат, нужно выяснить и устранить причину патологии.
Тренажер Самоздрав предназначен для нормализации естественных функций организма и поддержания нормального уровня и баланса нужных компонентов крови. Терапия, безусловно, принесет ожидаемый эффект при заболеваниях, спровоцированных недостаточным или нарушенным уровнем углекислого газа в крови. Анализируя отклики больных, прошедших лечение с использованием дыхательного тренажера Самоздрав, позитивная динамика наблюдается у более пожилых пациентов, которые жаловались на повышенное давление, нарушение в работе сердечно-сосудистой системы. С возрастом естественные сосудорасширяющие процессы организма притупляются и восстановление нормального уровня приводит к улучшению общего состояния здоровья. Однако, единичные случаи улучшения нельзя принимать за общепринятое правило, терять здравый смысл и лечить все болезни одним средством.
Для уверенности в положительном результате необходимо прежде всего определить точный диагноз и выяснить причины, которыми вызвано конкретное заболевание. С задачей нормализации уровняСО2 в крови аппарат, возможно, справится, если же причиной гипертонии стало, например, нарушение секреции щитовидной железы, то сомнительно, что тренировка дыхания приведет к выздоровлению. Надеяться останется лишь на эффект плацебо, ведь случаи полного оздоровления по причине позитивного программирования тоже известны официальной медицине.
Особенности протекания острого миелоидного лейкоза
Острый миелоидный лейкоз является раковым заболеванием крови. Данное заболевание характеризуется большим количеством незрелых аномальных лейкоцитов в крови, которые при этом слишком быстро размножаются. Данный тип лейкоза встречается и у детей, однако успешное лечение при выборе правильной тактики возможно.
Как проявляется
Заподозрить наличие миелоидного лейкоза можно уже при появлении первых симптомов. Таковыми являются слабость, одышка, повышенная температура тела, излишняя кровоточивость, частые инфекции. Приводит к этому неспособность костного мозга вырабатывать здоровые клетки крови в достаточном количестве.
Среди других симптомов выделяют:
- частые головные боли;
- рвота;
- чрезмерная раздражительность;
- болевые ощущения в костях, суставах.
Помимо этого могут часто наблюдаться поражения слизистых оболочек. Такое поражение затрагивает ротовую полость и желудочно-кишечный тракт. Воспаление слизистой рта дополняется припухлостью десен.
Большинство симптомов не являются специфическими. Поэтому при появлении неприятных ощущений необходимо обратиться к врачу с подозрениями. Он на основании полученных результатов лабораторных исследований назначит лечение. Проводится оно исключительно в условиях госпитализации.
Причины лейкоза
Основная причина появления миелоидного лейкоза связана с получением большой дозы радиации. Также провоцирующим фактором является использование химиотерапевтических средств во время лечения злокачественной опухоли.
Лейкозные клетки способны в большом количестве накапливаться в костном мозге. В результате этого новые здоровые клетки не могут больше образовываться, а старые просто разрушаются. Из-за этого правильные клетки крови не способны образовываться и в кровоток поступают только злокачественные.
С током крови эти клетки распространяются по всему организму, попадая в органы. Однако на этом их жизнедеятельность не заканчиваются. Там они продолжают расти и делиться, что приводит к образованию хлором (небольших по размеру опухолей) под кожей.
О проникновении лейкозных клеток в органы могут свидетельствовать различного рода заболевания, например, менингит, анемия, печеночная и почечная недостаточность и другие повреждения внутренних органов.
Среди других причин, которые вызывают острый миелолейкоз, выделяют:
- патологии на генетическом уровне (синдром Дауна, нейрофиброматоз, анемия Фанкони);
- миелодисплатический синдром;
- апластическая анемия;
- генетическая предрасположенность;
- неблагоприятная экология.
В группе риска находятся в большинстве случаев люди пожилого возраста.
Особенности диагностики
При подозрении на острый миелоидный лейкоз в условиях госпитализации необходимо пройти комплексное обследование:
- сдать кровь для полного анализа, который даст понятие о количестве здоровых клеток и о функционировании некоторых органов (печени, селезенки и других);
- пункция костного мозга (получение тканей костного мозги из полости кости: с помощью иглы, которая вводится в бедренную кость, врач берет небольшое количество материала и изучает на наличие раковых клеток);
- рентгеновское исследование;
- МРТ;
- ультразвуковое исследование;
- спинномозговая пункция (спинномозговая жидкость исследуется на наличие раковых клеток);
- хромосомный тест позволяет определить подтип миелоидного лейкоза (исследуется ДНК клеток крови и костного мозга);
- тест тканевого типирования проводится в случае необходимости трансплантации костного мозга путем сравнения белков-антигенов пациента и потенциального донора.
Острый миелоидный лейкоз диагностируется в том случае, когда при окраске реакция на миелопероксидазу более 3% бластов дает положительный результат.
Особенности лечения
Опасность данного типа лейкоза заключается в том, что заболевание быстро прогрессирует. Поэтому требуется не только своевременная диагностика и определение развития заболевания на ранней стадии, но и адекватное лечение, которое минимизирует неприятные последствия. Этот тип миелолейкоза характеризуется отсутствием промежуточных стадий. Заболевание может быть вновь диагностируемым, либо же находиться в стадии ремиссии (состояние организма, при котором какие-либо признаки заболевания отсутствует).
В целом лечение проходит в два этапа:
- Фаза индукции. Основная цель этого этапа – устранение раковых клеток, чем больше, тем лучше. Это мероприятие позволит достичь стадии ремиссии.
- Фаза пост-ремиссии. На данном этапе главной целью является поддержка полученного от терапии эффекта, а также устранение нежелательных последствий лечения.
Оба этапа включают в себя несколько видов терапии, которые могут использоваться обособленно либо же в комбинации друг с другом.
Существует четыре основных метода лечения миелолейкоза.
Химиотерапия
Главный метод – химиотерапия. Устранение раковых клеток в крови путем введения в организм специальных препаратов.
Проводится интерканальная терапия путем введения через поясничный прокол необходимых лекарственных средств. Данный метод введения препаратов обусловлен тем, что таким образом они попадают непосредственно в спинномозговую жидкость. Именно такой способ введения лекарства является наиболее эффективным, поскольку в этом месте скапливается большое количество раковых клеток.
Существуют и другие способы введения в организм химиотерапевтических препаратов: пероральный в виде таблеток или капсул, внутримышечно. Лекарственный препарат распространяется по кровотоку и убивает раковые клетки в нем.
Используется также и комбинированная химиотерапия, которая включает в себя применение нескольких химиотерапевтических препаратов.
Дозировка, способ применения зависит от степени миелоидного лейкоза.
Трансплантация стволовых клеток
При тяжелой степени заболевания, особенно у детей, может потребоваться трансплантация стволовых клеток. Проводится она исключительно после курса химиотерапии, которая убивает раковые клетки, присутствующие в организме.
Цель трансплантации – замещение аномальных клеток, которые впоследствии трансформируются в клетки крови, полноценными. Источником стволовых клеток является кровь или костный мозг как самого пациента, так и подходящего донора. Клетки изымаются из организма, замораживаются и сохраняются до операции. Вводятся они в организм больного путем инфузий.
Пересаженные клетки, после того как приживутся в новом организме, начинают выполнять функции замещенных, то есть восстанавливать в костном мозге клетки, которые отвечают за кроветворение.
Абсолютными показаниями к процедуре являются:
- транслокации и другие мутации в раковых клетках, которые связаны с высоким риском;
- рецидив заболевания;
- развитие острого миелоидного лейкоза на фоне различных заболеваний крови, а также в результате лечения злокачественного опухоли.
Использование трехокиси мышьяка и трансретиноевой кислоты
Эти препараты обладают противораковым действием. Они способны уничтожать лейкозные клетки, препятствовать их отделению и проникновению в здоровые ткани и органы. Эти медицинские препараты используются для лечения острого миелоидного лейкоза, в частности, одного из его подвидов – промиелоцитарного лейкоза.
Поддерживающая терапия
Данный вид лечения при остром миелоидном лейкозе играет важную роль. Особенность заключается в том, что все процедуры не требуют обязательной госпитализации пациента, поскольку интенсивность лечения гораздо ниже, чем в период индукции и пост-ремиссии. В качестве медицинских препаратов на данном этапе чаще всего используются цитарабин, метотрексат, глюкокортикоиды.
Помимо этого снижают риск рецидива заболевания путем профилактической химиотерапии, особенно у детей, поскольку острый миелолейкоз переходит на центральную нервную систему достаточно легко.
Общая продолжительность лечения с учетом прохождения всех этапов составляет от 2 месяцев до двух лет.
Прогноз
Успешность лечения зависит от многих факторов. В первую очередь от своевременности терапии. Без лечения острый миелоидный лейкоз приводит к летальному исходу в короткие сроки. Помимо этого на результат терапии влияет подвид миелолейкоза, цитогенетические особенности заболевания, возраст пациента (с возрастом шанс на излечение уменьшается), общего состояния больного.
Развитие иммунной системы в онтогенезе
■
Большинство
клеток
иммунной
системы
образуется из гемопоэтических стволовых клеток.
■
Развитие
клеток
разных
типов
(
рядов
,
или
линий
, дифференцировки)
зависит от межклеточных взаимодействий и цитокинов.
■
Лимфоидные
стволовые
клетки
развиваются и созревают в первичных лимфоидных органах. Этот процесс называется лимфопоэзом.
■
Т
—
лимфоциты
при развитии в тимусе подвергаются положительной и отрицательной селекции.
■
В
—
клетки
млекопитающих
развиваются главным образом в печени плода, а после рождения — в костном мозге. Этот процесс продолжается в течение всей жизни организма. В-клетки в местах своего развития также подвергаются отбору.
■
Р
епертуар антител
, существующий у взрослых особей, формируется в процессе лимфопоэза путем рекомбинации генных сегментов, кодирующих ТкР и Ig.
■
В
центрах
размножения
происходит олигоклональная пролиферация В-клеток, переключение изотипа антител, повышение аффинности и формирование иммунологической памяти.
Эффективное функционирование иммунной системы зависит от взаимодействия многочисленных клеточных и гуморальных компонентов, которые в пре- и постнатальный периоды созревают с различной скоростью. Многие клетки, участвующие в иммунном ответе, происходят от недифференцированных гемопоэтических стволовых клеток (ГСК). Под влиянием факторов микроокружения — взаимодействия с соседними клетками и присутствия растворимых или мембраносвязанных цитокинов — дифференцировка ГСК происходит в разных направлениях (рис. 12.1).
Рис. 12.1. Все изображенные на рисунке клетки происходят от гемопоэтической стволовой клетки. Тромбоциты, продуцируемые мегакариоцитами, поступают в кровоток. Гранулоциты и моноциты мигрируют из кровотока в ткани. Тучные клетки присутствуют во всех тканях. В-клетки у млекопитающих созревают в печени плода и костном мозге, а Т-клетки — в тимусе. Местом образования больших гранулярных лимфоцитов, обладающих активностью нормальных киллеров (НК), служит, вероятно, костный мозг. Лимфоциты мигрируют из кровотока, проходят через вторичные лимфоидные ткани и вновь поступают в кровоток. Роль антигенпрезентирующих клеток во вторичных лимфоидных тканях выполняют интердигитатные и дендритные клетки.
У млекопитающих в период внутриутробного развития ГСК присутствуют в желточном мешке, печени, селезенке и костном мозге. После рождения и в зрелом организме они обычно сохраняются лишь в костном мозге. Эти «самообновляющиеся» путем деления ГСК под влиянием разнообразных местных (в участках гемопоэза) факторов роста и дифференцировки дают начало большинству или даже всем клеткам иммунной системы.
Из ГСК образуются клетки четырех главных рядов (линий) дифференцировки:
• эритроидного (эритроциты),
• мегакариош(тарного (тромбоциты),
• миелоидного (гранулоииты и моноядерные фагоциты) и
• лимфоидного (лимфоциты). Антигенпрезентируюшие клетки в основном, но не исключительно, развиваются из миелоидных клеток-предшественников. Клетки миелоидного и лимфоидного рядов наиболее важны для функционирования иммунной системы.
МИЕЛОИДНЫЕ КЛЕТКИ
У человека миелопоэз начинается в печени, примерно на 6 неделе внутриутробного развития. Изучение роста колоний из индивидуальных стволовых клеток in vitro показало, что первая образующаяся из ГСК клетка-предшественник представляет собой колониеобразующую единицу (КОЕ), которая может дать начало образованию гранулоцитов, эритроцитов, моноцитов и мегакариоцитов (КОЕ-ГЭММ). Созревание этих клеток происходит под влиянием колониестимулируюших факторов (КСФ) и ряда интерлейкинов, в том числе ИЛ-1, ИЛ-3, ИЛ-4, ИЛ-5 и ИЛ-6 (рис. 12.2). Все они играют важную роль в положительной регуляции (стимуляции) гемопоэза и продуцируются главным образом стромальными клетками костного мозга, но также и зрелыми формами дифференцированных миелоидных и лимфоидных клеток. Другие цитокины (например, ТФРβ) могут осуществлять понижающую регуляцию (подавление) гемопоэза.
Рис. 12.2. Полипотентные гепомоэтические стволовые клетки превращаются в колониеобразующие единицы (КОЕ) КОЕ-ГЭММ может давать начало всем клеткам крови, за исключением лимфоцитов. Образование из стволовой клетки любого из пяти типов клеток [мегакариоцитов, эритроцитов — через этап предшественника, называемого взрывообразующей единицей эритроидного ряда (ВОЕ-Э), базофилов, нейтрофилов или эозимофилов] индуцирует ИЛ-3 и фактор, стимулирующий образование колоний гранулоцитов и макрофагов (ГМ-КСФ); эти же факторы необходимы для дальнейшей дифференцировки гранулоцитов и моноцитов. Образование эозинофилов (Э) и КОЕ-3 стимулируется ИЛ-5. Нейтрофилы и моноциты образуются из КОЕ-ГМ под действием соответственно Г-КСФ и М-КСФ. Оба эти фактора, как и другие цитокины (включая ИЛ-1, ИЛ-4 и ИЛ-6), стимулируют дифференцировку моноцитов в макрофаги. Образование мегакариоцитов стимулируется тромбопоэтином (ТП) (Б — базофил; ЭЛ — эритропоэтин; Г — гранулоцит; М — моноцит.)
Нейтрофилы и моноциты развиваются из общих клеток-предшественников
Образование нейтрофилов
. Клеткой — предшественником нейтрофилов (вид гранулоцитов) и мононуклеарных фагоцитов (макрофагов) служит КОЕ-ГМ. При дифференцировке в нейтрофилы клетки проходят несколько морфологических стадий. Из миелобластов образуются промиелоциты и затем миелоциты, которые созревают и поступают в кровоток в виде нейтрофилов. Однонаправленная дифференцировка клеток КОЕ-ГМ в зрелые нейтрофилы обусловлена появлением у них на разных стадиях развития рецепторов для специфических факторов роста и дифференцировки.
По мере созревания гранулоцитов на их поверхности исчезают или появляются поверхностные дифференцировочные маркеры (рис. 12.3). Например, клетки КОЕ-ГМ экспрессируют молекулы МНС класса II и маркер CD38, отсутствующие на зрелых нейтрофилах. К другим молекулам поверхности, экспрессируемым в процессе дифференцировки, относятся CD13, CDI4
(представлен в небольшой концентрации), CD15 (Х-детерминанта группы крови Льюис), CD29 (β
1
-интегрин), VLA-4 (CD49d, α-цепь), лейкоцитарные интегрины CD11а, b, с и αD в ассоциации с β
2
-цепями CD18, рецепторы комплемента и Fcγ-рецепторы (CD 16) (см. рис. 2.42).
Рис. 12.3. Клетки моноцитарного и нейтрофильного линий дифференцировки образуются из общей клетки-предшественника, КОЕ-ГМ. Дифференцировка по каждому из этих путей сопровождается утратой маркера CD34. На моноцитах сохраняется CD33, тогда как на зрелых нейтрофилах эти молекулы, равно как и молекулы МНС класса It, отсутствуют. Маркер CD14 экспрессируется на моноцитах, но лишь в слабой степени на некоторых гранулоцитах, возможно при активации.
Функциональную активность гранулоцитов, находящихся на различных стадиях созревания, оценить трудно, но, по-видимому, полным функциональным потенциалом обладают только зрелые клетки. Ряд данных свидетельствует о том, что активность нейтрофилов, определяемая по фагоцитозу или хемотаксису, у плода ниже, чем в зрелом организме. Однако это может быть отчасти связано с меньшим содержанием опсонинов в сыворотке плода, а не с особенностями самих клеток. Для приобретения активности нейтрофилам необходимо непосредственное взаимодействие с микроорганизмами или с цитокинами, образующимися при иммунном ответе на антиген, (или с теми и другими вместе) в присутствии опсонинов. Это может лимитировать активность нейтрофилов на раннем этапе развития организма. Активация нейтрофилов цитокинами и хемокинами является также необходимым условием их миграции из крови в ткани.
Образование моноцитов
. При дифференцировке по моноцитарному пути из КОЕ-ГМ вначале образуются пролиферирующие монобласты. Они дифференцируются в промоноциты и, наконец, в зрелые моноциты крови. Считается, что циркулирующие моноциты служат возобновляемым пулом для образования тканевых макрофагов, например макрофагов легких. Различные формы макрофагов составляют систему мононуклеарных фагоцитов (см. гл. 2).
Зрелые нейтрофилы и моноциты/макрофаги лишены CD34 и других маркеров ранних стадий дифференцировки. Однако моноциты, в отличие от нейтрофилов, продолжают экспрессировать большое количество молекул МНС класса II (рис. 12.3), необходимых для презентации антигена Т- клеткам. Моноциты синтезируют также многие из тех поверхностных молекул, которые характерны для зрелых нейтрофилов (см. рис. 2.28).
На стадиях дифференцировки определить функциональные возможности моноцитов, как и гранулоцитов, весьма трудно. Однако изучение in vitro некоторых миелоидных опухолей, клетки которых предположительно представляют собой моноциты на разных стадиях дифференцировки, свидетельствует о том, что как фагоцитарная активность, так и цитотоксичность, опосредуемая Fc-рецептором, достигают оптимального уровня только на стадии зрелых макрофагов. У новорожденного и взрослого человека моноциты вырабатывают цитокин ИЛ-1 с равной эффективностью, но у новорожденного эта функция слабее повышается под действием ИФγ, чем у взрослого.
Дендритные клетки развиваются из стволовых клеток костного мозга
Большинство классических антигенпрезентирующих клеток (АПК), включая макрофаги, клетки Лангерганса, интердигитатные и дендритные клетки, присутствует в организме уже при рождении. По всей вероятности, основная их масса образуется из стволовых клеток костного мозга. Возможно, они происходят из одной и той же клетки-предшественника CD34+
(КОЕ-ГЭММ). Морфологические, цитохимические и функциональные особенности разных АПК должны тогда определяться последующим влиянием факторов микроокружения, например цитокинов. Другая возможность состоит в том, что АП К образуются из разных стволовых клеток и по разным направлениям дифференцировки. Важное исключение составляют фолликулярные дендритные клетки (ФДК), локализованные в центрах размножения внутри вторичных лимфоидных фолликулов и происходящие, возможно, от мезенхимных клеток. В первичных фолликулах периферических лимфоидных тканей ФДК присутствуют уже при рождении. В отличие от других АПК они лишены подвижности.
Уже на очень ранних стадиях развития организма АПК присутствуют в тимусе, причем их участие в МНС-рестрикции и селекции Т-клеток показывает, что по крайней мере некоторые из них к этому времени достигают полной зрелости. Однако активность АПК на ранних стадиях развития организма явно неоптимальна. У новорожденных крысят, например, образование антител к эритроцитам барана происходит только при одновременном введении АПК взрослых крыс (рис. 12.4).
Рис. 12.4. Развитие функции антигенпрезентирующей клетки процессинга и презентации антигена. В этом опыте новорожденным крысятам вводили: 1) только эритроциты барана (ЭБ), 2) ЭБ + клетки селезенки (содержащей АПК) взрослых крыс, 3) ЭБ + клетки селезенки, лишенной АПК, или 4) ЭБ + зрелые тимоциты. Во всех случаях взрослые крысы принадлежали к той же линии, что и новорожденные. У крысят каждой группы регистрировали гуморальный иммунный ответ — появление антител. У новорожденных крысят, которым вводили только ЭБ, антитела к ЭБ антигенам не образовывались. Однако при одновременном введении спленоцитов взрослых крыс (вариант 2) иммунный ответ развивался. Ни зрелые спленоциты в отсутствие АПК, ни тимоциты сами по себе не вызывали продукции антител. Следовательно, АПК новорожденных особей неспособны эффективно осуществлять процессинг и презентацию ЭБ-антигенов.
Частые вопросы
Что такое клетки миелоидного ряда?
Клетки миелоидного ряда – это группа кроветворных клеток, которые происходят от общего предка в костном мозге и играют важную роль в иммунной системе организма.
Какие функции выполняют клетки миелоидного ряда?
Клетки миелоидного ряда выполняют ряд функций, включая фагоцитоз (поглощение и уничтожение бактерий и других чужеродных частиц), продуцирование цитокинов, участие в воспалительных процессах и формирование иммунного ответа.
Полезные советы
СОВЕТ №1
При изучении клеток миелоидного ряда обратите внимание на их морфологию, включая форму, размер, ядрышко и цитоплазму. Это поможет вам правильно идентифицировать различные типы клеток.
СОВЕТ №2
Изучите функции клеток миелоидного ряда, такие как фагоцитоз, синтез и выделение цитокинов, участие в воспалительных процессах и иммунном ответе. Понимание их функций поможет вам лучше понять их роль в организме.
СОВЕТ №3
Ознакомьтесь с патологиями, связанными с клетками миелоидного ряда, такими как лейкемии и миелодиспластические синдромы. Понимание этих заболеваний поможет вам распознавать их при морфологическом исследовании клеток.